Research
当研究室では、体の中で機能するナノバイオマテリアルに関する研究を行っています。サイズや表面の性質が調節されたナノバイオマテリアルを設計・利用することで、生体内での物質の移動や分布を一定のレベルで制御することができます。結果として、医薬品の薬効の増強や副作用の低下、あるいは特定の生体シグナルの高感度検出が可能になります。
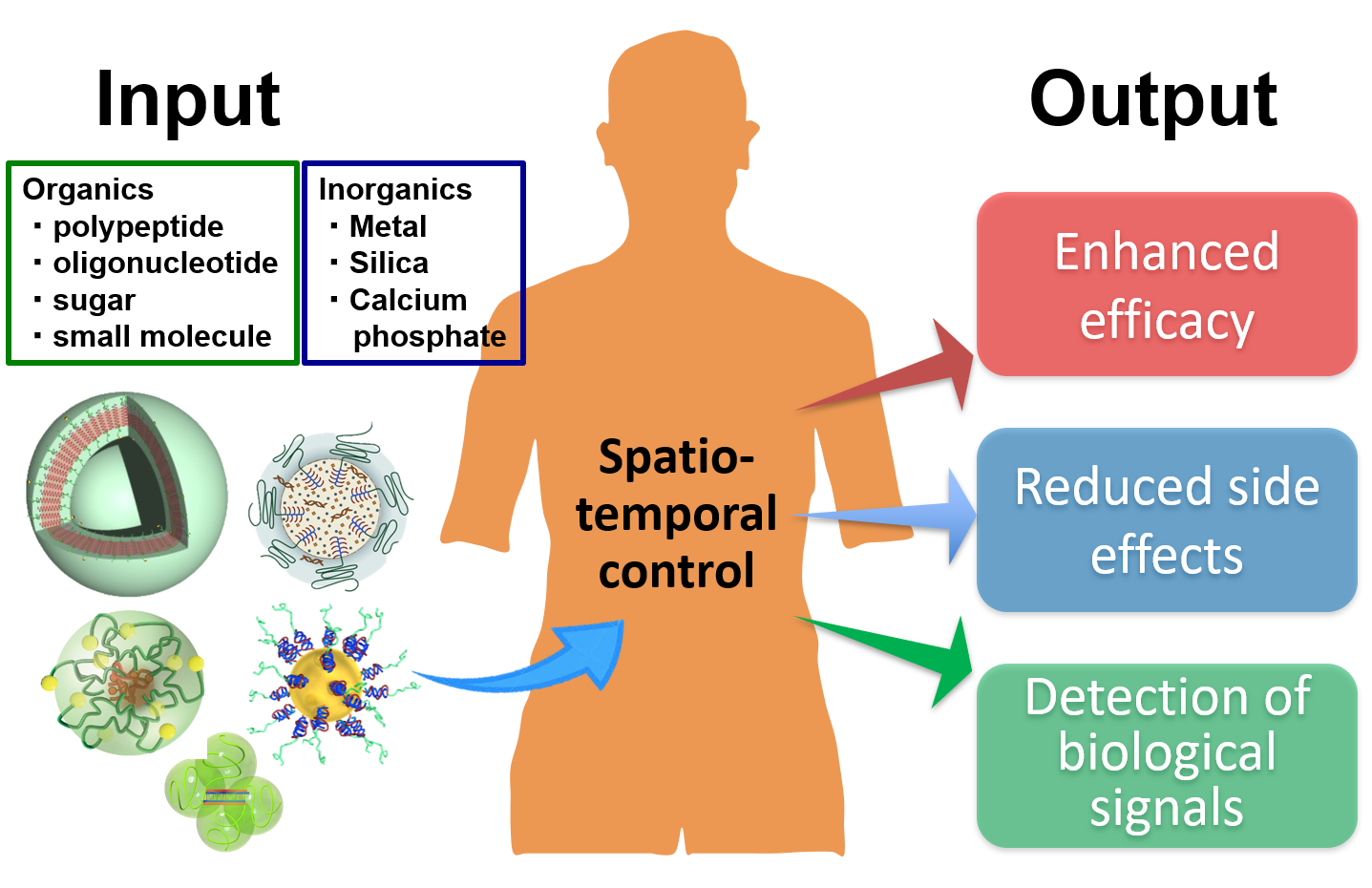
私達は、特に核酸医薬に代表されるバイオ医薬品に注目しています。核酸医薬は、多くの難治性疾患の治療に適用できる優れたポテンシャルを有しています。しかしながら、生体内での安定性は十分とはいえず、また標的とする細胞に取り込まれにくいなどの課題を抱えており、実用化はあまり進んでいません。これらの課題を解決するのが、上述のナノバイオマテリアルを用いて調製される「ナノ医薬」です。ナノ医薬は、医薬単体の欠点を克服する、あるいは長所を増幅するように設計されます。例えば、抗がん剤の腫瘍組織への集積効率を高め、正常組織への移行効率を低下させることができます。また、特定の細胞内への移行効率を促進することも可能です。
私達は、高分子材料を基盤として無機材料などをハイブリッドすることで、新たなナノバイオマテリアルおよびナノ医薬を創出しています。以下に、私達が特に力を入れている研究とその成果を紹介します。
研究一覧
- 世界最小スケールの核酸医薬搭載ナノ医薬 『ユニットポリイオンコンプレックス』
- ゲノム編集を実行する生体内CRISPR-Cas発現システム 『ナノエディター』
- 核酸分子を保護するシリカ被覆ナノ粒子『PicSil(ピクシール)』
- 生体内間隙を潜り抜ける精密サイズ調整可能な高分子材料 『ナノルーラー』
世界最小スケールの核酸医薬搭載ナノ医薬 『ユニットポリイオンコンプレックス』
1990 年代より、がんを標的とする様々なナノ医薬が開発されてきました。研究レベルでの優れた成果と比べ、ヒトがん患者での臨床試験は苦戦を強いられています。その理由の 1 つとして、研究レベルでのがん(担がんマウスモデル)とヒトのがんでは、組織構造が異なることが指摘されています。より長い時間をかけて成長するヒトのがん組織の方が、不均一性が大きく、また血管密度が低いことや線維質の組織(間質と呼ばれる)を多く含むことが報告されています。このような課題を解決するための方法論として、私達はナノ医薬のダウンサイジングに注目しました。つまり、サイズの小さなナノ医薬を設計することで、がん組織や間質に存在するわずかな隙間を擦り抜けてがん細胞にたどり着けるのではないかと考えました。
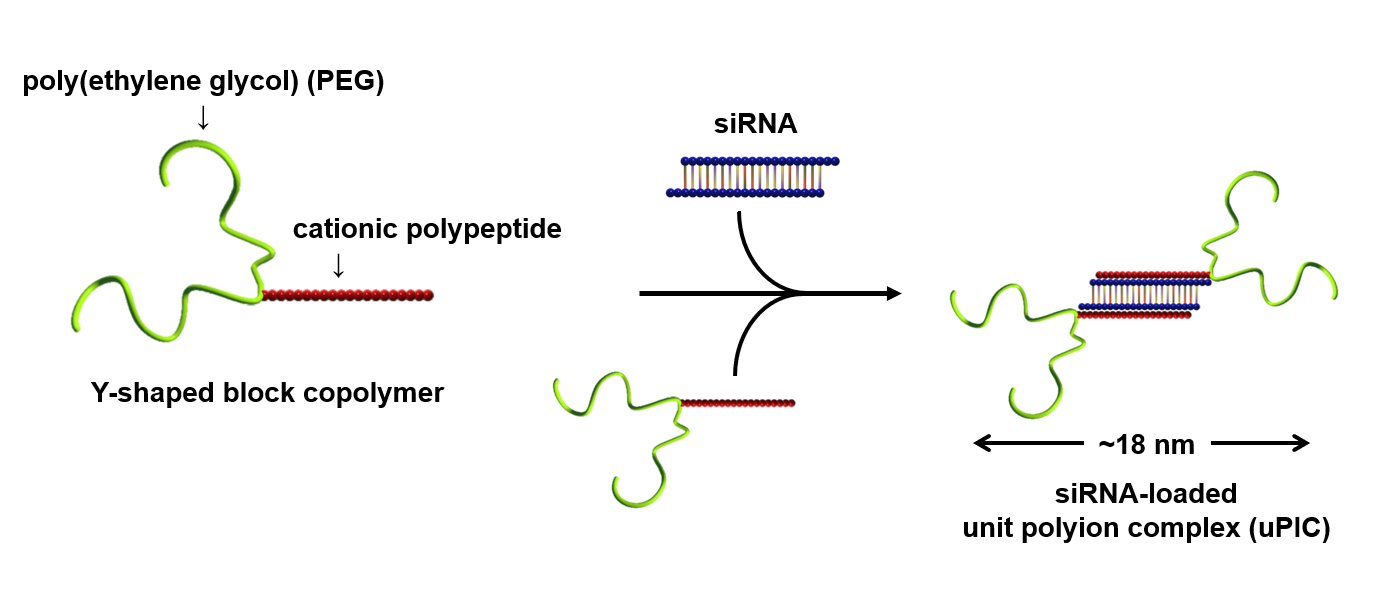
最小スケールの核酸医薬(siRNA やアンチセンス核酸)搭載ナノ医薬を設計するために、私達はポリマーの長さと形に注目しました。具体的には、図に示すような Y 字型のポリマーを作りました。これは、2 分岐の生体適合性ポリマー(ポリエチレングリコール(PEG))とカチオン性ポリペプチドから構成されます。このカチオン性ポリペプチドは、siRNA の有する負電荷(一般的には 40)の半分に相当する正電荷(すなわち 20)を含むように合成されます。これにより、2 分子の Y 字型ポリマーが 1 分子の siRNA の負電荷を中和する形で複合体(ポリイオンコンプレックスと呼ばれる)が形成されます。特に、1 分子の siRNA を選択的に搭載することから、最小単位のポリイオンコンプレックスとして『ユニットポリイオンコンプレックス(uPIC)』と名付けました。この uPIC は、4分子の長鎖 PEG により生み出される立体反発効果を有するため、自己凝集が抑制されています。その結果、生体内で約 18 nm という最小スケールのナノ医薬となります。このサイズは、既存の siRNA 搭載ナノ医薬(約 100 nm)と比べ、1/5 以下に相当します。
設計当初、uPIC が生体内(血流中)でどれくらい安定かは未知数でした。既存のナノ医薬は、約 100 nm のナノ粒子に siRNA をがっちりと封入する設計です。それに比べ、2 分子の Y 字型ポリマーで siRNA を保護する uPIC は、安定性が低いことが懸念されました。しかしながら、uPIC の血流中での安定性は非常に高いことが確認されました。現在、この安定化メカニズムは動的平衡により説明されています。
つまり、過剰に添加された Y 字型ポリマーが置き換わりながら siRNA に結合することで、血流中で uPIC を安定化するのです。従って、ナノ粒子を共有結合などにより安定化する既存の方法論とは全く異なる安定化メカニズムと言えます。続いて、線維性膵臓がん皮下移植モデル、自然発生膵臓がんモデル、および脳腫瘍同所移植モデルマウスに得られた uPIC を適用したところ、優れたがん組織集積性と治療効果を得ることに成功しました(Nat. Commun. 10, 1894 (2019))。
uPICの安定性に関しては、Y字型ポリマーだけでなく、核酸医薬自体の構造も重要であることが見出されています。具体的には、ヌクレアーゼ耐性を有する化学修飾 siRNA を用いると、uPIC の血中半減期が 7 倍近く増加すること、および 1 本鎖のアンチセンス核酸を 2 本鎖(ヘテロ核酸)化すると 2 倍近く増加することが確認されています(J. Control. Release 330, 812 (2021))。
がん治療用 siRNA 搭載 uPIC については、2020年9月より医師主導治験が進められています。一方、当研究室では、がん組織集積性をさらに高める新たな設計、およびがん以外の疾患組織への適用可能性の探索を進めています。
ゲノム編集を実行する生体内CRISPR-Cas発現システム 『ナノエディター』
近年、2020 年のノーベル化学賞に象徴されるように、CRISPR-Cas(Clustered Regularly Interspaced Short Palindromic Repeats-CRISPR Associated Proteins)によるゲノム編集が注目されています。CRISPR-Cas は、他のゲノム編集技術と比べ、標的遺伝子の設定が容易という大きな長所を有しています。一方、このゲノム編集を医療へと応用するためには、生体内で標的細胞に CRISPR-Cas 成分(ガイド RNA と Cas タンパク質あるいは Cas をコードした DNA や RNA)を選択的かつ効率良く導入する技術が求められます。細胞内に CRISPR-Cas 成分を導入する技術として、ウイルスを改変して用いる方法論が主流です。しかしながら、ウイルス型ナノ医薬は免疫原性や変異原性のリスクがあること、また超高額医療となることが懸念されます。そこで私達は、ウイルスに代わる方法論として、非天然ポリペプチドを用いた CRISPR-Cas 発現システムの研究を行っています。具体的には、下図に示されるように酸解離定数や疎水性が調節された両親媒性ポリペプチドを設計し、Cas をコードしたメッセンジャー RNA(mRNA)内包ナノ医薬『ナノエディター』を構築します。得られたナノエディターを遺伝子改変(Ai9)マウスの脳室内あるいは髄腔内に投与したところ、広範囲の脳室上衣組織にてゲノム編集が誘導されたことを確認しました(ACS Cent. Sci. 5, 1866 (2019))。
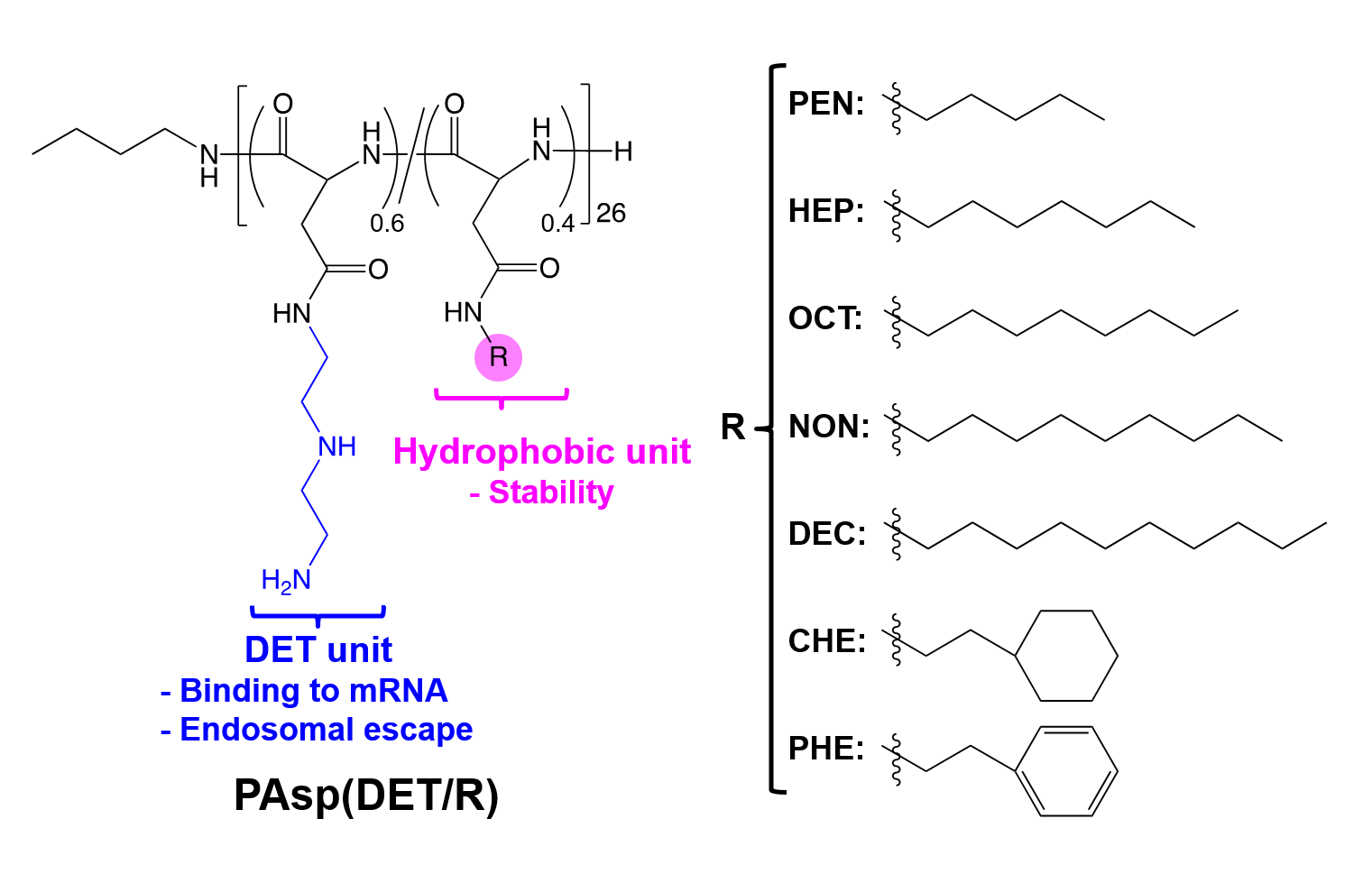
本ナノエディターに関しては、アルツハイマー病や筋ジストロフィーなどの難病治療を目指して研究中です。
核酸分子を保護するシリカ被覆ナノ粒子 『PicSil(ピクシール)』
2020年、新型コロナウィルス感染症(COVID-19)のパンデミックにより世界中の様々な活動が停滞してしまいました。その感染症に対するワクチンとして、メッセンジャーRNA(mRNA)を用いたワクチンがいち早く登場し、優れた効果を示しています。またmRNAは、COVID-19だけでなく他の感染症に対するワクチンとしての研究が進められているほか、がんや先天性遺伝子疾患の治療薬としても期待されています。しかしながら、mRNAは酵素分解を受けやすく、体内に投与されると速やかに失活してしまいます。そのため、mRNA医薬の医療応用を実現するためには、投与部位から標的細胞までmRNAを分解から保護しながら送り届ける方法論が求められています。
そこで私達は、mRNAを酵素分解から保護するため、無機材料であるシリカに着目しました。具体的には、下に示すように、負電荷を帯びるmRNAと正電荷を帯びるポリマーから形成されるポリイオンコンプレックス(PIC)をシリカ層で密封した有機・無機材料ハイブリッド『PicSil(ピクシール)』を構築します。シリカは、シラノール基(Si-OH)と、その縮合した構造であるシロキサン結合(Si-O-Si)がネットワーク状に結びつく無機材料です。このネットワーク構造がバリアーとなり、mRNA分解酵素のアクセスを効果的に阻害します。実際に、mRNA分解酵素を含む緩衝液中で一定時間静置したところ、ピクシールに内包されたmRNAは、PICと比べて100倍以上安定であることが明らかになりました。現在、負電荷を帯びたシリカナノ粒子がマクロファージに積極的に取り込まれる性質に着目し、ピクシールを用いたマクロファージ特異的なmRNA送達を研究しています。培養マクロファージを用いた実験では、ピクシールは、PICと比べて20倍近く高いmRNA送達効率を示すことが明らかになっています。

またピクシールは、内包する核酸を mRNA から他の核酸に替えることによって、プラスミド DNA(Biomaterials 31 4764 (2010))やsiRNA(J. Biomater. Sci. Polym. Ed. 28 1109 (2017), Biomaterials 34 562 (2013), ACS Nano 6 6693 (2012))などの送達に応用することも可能です。
生体内間隙を潜り抜ける精密サイズ調整可能な高分子材料 『ナノルーラー』
体内に投与された薬物は、血液の流れに乗って全身を循環し、血管壁に開いた穴、血管内皮細胞の間隙を通過して組織へと移行します。この際に重要となるのが薬物のサイズです。血管細胞間隙の大きさは組織に応じて様々ですが、一般的には直径数十 ~ 1000 nmほどと言われています。物理的にはサイズを小さくするほど拡散性や浸透性が高くなり、狭い細胞間隙や間質組織などの生体バリアを突破するのに有利であると考えられます。実際に、当研究室の開発した世界最小スケール(直径約18 nm)の核酸医薬搭載ナノ医薬「ユニットポリイオンコンプレックス(uPIC)」は、従来のナノ医薬(直径 30 ~ 100 nm)と比べて効率的に生体バリアを突破し、膵臓がんや脳腫瘍といった難治性がんに対する高い抗腫瘍効果を実現しました。
それでは、薬物のサイズは小さければ小さいほどよいのかというと、そういうわけではありません。生体内では直径約 5 ~ 8 nm未満の物質は腎臓から尿として排泄され、速やかに血中から消失してしまうため、その閾値を上回るサイズに制御する必要があります。一方で、サイズを大きくしすぎると血管壁の透過性や組織浸透性が低下してしまうことに加えて、免疫細胞に捕捉されやすくなり、血中からの消失速度が大きくなってしまいます。したがって、生体バリアを突破し標的の組織へ薬物を送達するには、ナノ医薬のサイズを適切に設計する必要があります。
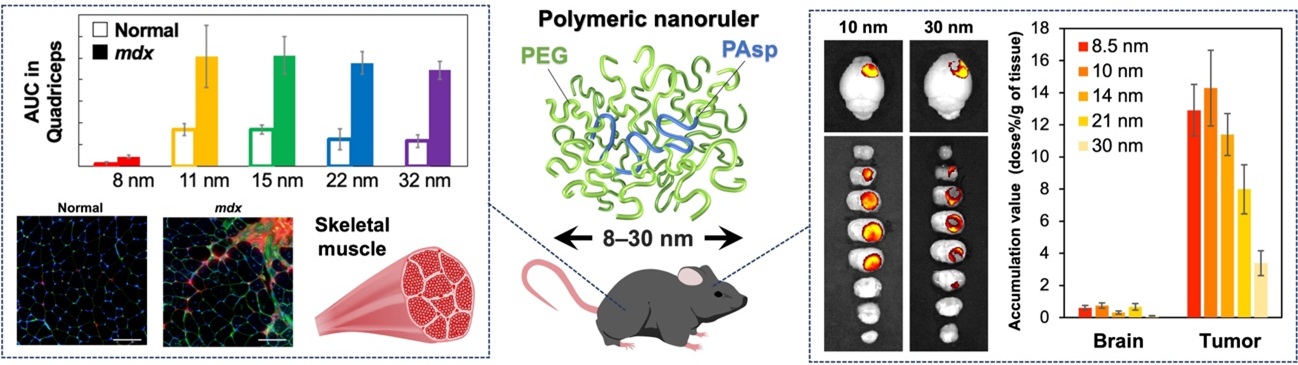
そこで私たちは、生体内におけるナノ医薬のサイズ効果を調べるために、精密なサイズ制御が可能な高分子ものさし「ナノルーラー」を開発しました。ナノルーラーは、生体適合性高分子としてナノ医薬の表層修飾に広く用いられるポリエチレングリコール(PEG)をポリアスパラギン酸(PAsp)の側鎖に導入したグラフト共重合体と呼ばれる単体の高分子です。分子量に基づいて 8 ~ 30 nmの範囲で精密にサイズを制御することができ、血中を安定に循環することで生体内でのサイズ効果を調べる「ルーラー」として機能します。
実際に、ナノルーラーを用いることで、心筋および骨格筋へ効率的に集積するナノ医薬サイズ(10 ~ 15 nm)や、炎症性の筋組織ではサイズに関わらず集積量が正常組織よりも 2 ~ 3 倍増加することを明らかにしました (J. Control. Release 347, 607, (2022))。また、血液―脳腫瘍関門と呼ばれる血管内皮細胞間隙が微小な構造をもつ悪性脳腫瘍では、従来のナノ医薬と同等サイズである 30 nmと比較して、10 nmにダウンサイジングすることで集積量が約 4 倍増加し、脳腫瘍の中心部へも浸透が可能になることを明らかにしました (Bioconjugate Chem. 35(8), 1154, (2024))。サイズ制御性と血中での高い安定性・滞留性を持つナノルーラーは、生体内でナノ医薬のサイズ効果を調べる有用なプラットフォームとして今後もさらなる応用が期待できます。